miRAN 分析以及mRNA分析
一些参考资料
http://www.360doc.com/content/17/0528/22/19913717_658086490.shtml
https://www.cnblogs.com/triple-y/p/9338890.html
一、对miRNA进行分析
1、bowtie比对
"bowtie -q -v 2 -l 10 -k 15 /data/pub/shehb/Spinach_genome/spinach_genome_v1.fa "+fq+" -S "+fq+".sam >mapping.info"
2、HTSeq 计算reads数量 (详细:http://www.chenlianfu.com/?p=2438)
(1)HTSeq是对有参考基因组的转录组测序数据进行表达量分析的,其输入文件必须有SAM和GTF文件。
(2)一般情况下HTSeq得到的Counts结果会用于下一步不同样品间的基因表达量差异分析,而不是一个样品内部基因的表达量比较。因此,HTSeq设置了-a参数的默认值10,来忽略掉比对到多个位置的reads信息,其结果有利于后续的差异分析。
(3)输入的GTF文件中不能包含可变剪接信息,否则HTSeq会认为每个可变剪接都是单独的基因,导致能比对到多个可变剪接转录本上的reads的计算结果是ambiguous,从而不能计算到基因的count中。即使设置-i参数的值为transcript_id,其结果一样是不准确的,只是得到transcripts的表达量。
run = "htseq-count -s no -t mRNA -i ID "+sam+" ./Spinach_genome/spinach_gene_v1miRNA.gff3 > "+sam+"count_out.txt"
参数:
-f | --format default: sam 设置输入文件的格式,该参数的值可以是sam或bam
-r | --order default: name 设置sam或bam文件的排序方式,该参数的值可以是name或pos。,但HTSeq推荐使用name排序,且一般比对软件的默认输出结果也是按name进行排序的。
-s | --stranded default: yes 设置是否是链特异性测序。该参数的值可以是yes,no或reverse。no表示非链特异性测序;若是单端测序,yes表示read比对到了基因的正义链上;若是双末端测序,yes表示read1比对到了基因正义链上,read2比对到基因负义链上;reverse表示双末端测序情况下与yes值相反的结果。根据说明文件的理解,一般选择no, yes是成对的reads数量-a | --a default: 10 忽略比对质量低于此值的比对结果。在0.5.4版本以前该参数默认值是0。 -t | --type default: exon 程序会对该指定的feature(gtf/gff文件第三列)进行表达量计算,而gtf/gff文件中其它的feature都会被忽略。 比如:在mRNA中,选择exon,表示只计算exon的reads数量-i | --idattr default: gene_id 设置feature ID是由gtf/gff文件第9列那个标签决定的;若gtf/gff文件多行具有相同的feature ID,则它们来自同一个feature,程序会计算这些features的表达量之和赋给相应的feature ID。 看基因前面的标志是什么-m | --mode default: union 设置表达量计算模式。该参数的值可以有union, intersection-strict and intersection-nonempty。这三种模式的选择请见上面对这3种模式的示意图。从图中可知,对于原核生物,推荐使用intersection-strict模式;对于真核生物,推荐使用union模式。 -o | --samout 输出一个sam文件,该sam文件的比对结果中多了一个XF标签,表示该read比对到了某个feature上。 -q | --quiet 不输出程序运行的状态信息和警告信息。 -h | --help 输出帮助信息。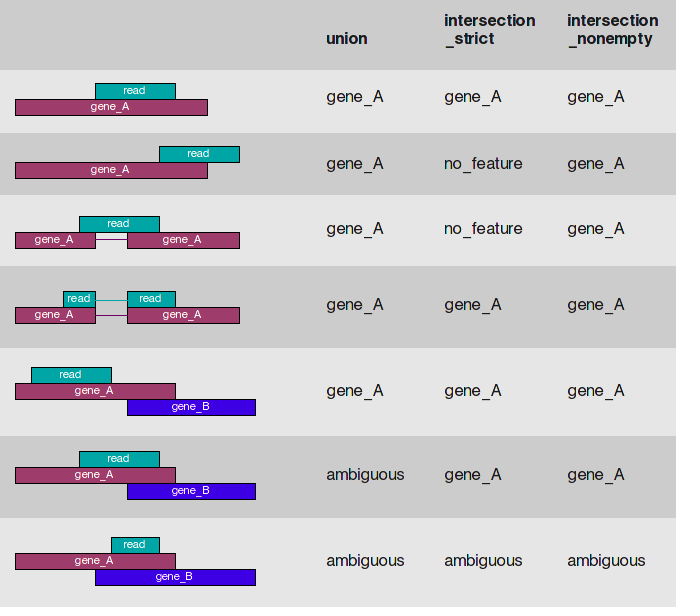
1 paste *.txt |awk '{printf $1"\t";for(i=2;i<=18;i+=2)printf $i"\t";printf $i"\n"}' |less -S
2
3 ##18 为总共有多少列
3、对于有重复的样本用DESeq2进行分析
自认为感觉不是很好安装包 ,我用下前面方法安装上去的
若R安装包出现package ‘xx’ is not available (for R version 3.4.2)的问题时:
用以下方法安装包
source("http://bioconductor.org/biocLite.R")
biocLite("包名")
DESeq2对于输入数据的要求
1.DEseq2要求输入数据是由整数组成的矩阵。
2.DESeq2要求矩阵是没有标准化的。
DESeq2进行差异表达分析
DESeq2包分析差异表达基因简单来说只有三步:构建dds矩阵,标准化,以及进行差异分析。
1、构建dds矩阵
需要:(1)countData, 是readscount计算后,合并的形成的矩阵。行为基因名字,列为样本
(2)colData, 样本信息,标出哪些是control,哪些是treat。第一列样品名称(其实就是countData第一行的名称),第二列是样品处理情况(对照还是处理等),condition的类型是一个factor。
(3)差异比较矩阵 即上述代码中的design。 差异比较矩阵就是告诉差异分析函数是要从要分析哪些变量间的差异,简单说就是说明哪些是对照哪些是处理。
library(S4Vectors)
library(stats4)
library(BiocGenerics)
library(parallel)
library(IRanges)
library(GenomicRanges)
library(GenomeInfoDb)
library(SummarizedExperiment)
library(Biobase)
library(DelayedArray)
library(matrixStats)
library(DelayedArray)
library(DESeq2)
library(ggplot2)
setwd("/Users/hongbingshe/Desktop")
condition <- factor(c("XX","XX","XX","XY","XY","XY"))
countData <- read.table("XX_XYmiRNA.count_out",header = T,sep = "\t",row.names = "X") ##open file
colData <- data.frame(row.names = colnames(countData),condition)
dds <- DESeqDataSetFromMatrix(countData,DataFrame(condition),design = ~ condition)
head(dds) ##
dds2 <- DESeq(dds) ###normalize rlogTransformation(dds2). ???
resultsNames(dds2) ###objective name
res <- results(dds2)
summary(res) ###infomation
table(res$padj<0.05) ##number of true 小于0.05 的基因个数
res <- res[order(res$padj),]
diff_gene_deseq2 <- subset(res,padj <0.05 & (log2FoldChange >1 |log2FoldChange < -1)) ###FC >1, P <0.05
differ_gene_deseq2 <- row.names(diff_gene_deseq2)
resdata <- merge(as.data.frame(res),as.data.frame(counts(dds2,normalize=TRUE)),by="row.names",sort=FALSE)
write.csv(resdata,file = "/Users/hongbingshe/Desktop/XX_XYmiRNA.cvs",row.names = F) ##output file
resdata[which(resdata$padj < 0.05 & resdata$log2FoldChange > 1 ),'significant'] <-'up'
resdata[which(resdata$padj < 0.05 & resdata$log2FoldChange < -1 ),'significant'] <-'down'
resdata[!resdata$significant%in%c('up','down'),'significant'] <- 'no'
p <- ggplot(resdata,aes(resdata$log2FoldChange,-log10(resdata$padj))) + geom_point(aes(color=significant),size=0.5) +scale_color_manual(limits=c('up','down','no'),values = c('blue','red','gray40')) +labs(x="log2(Fold Change)",y="-log10(P-value)")
p <- p + theme(panel.grid.major = element_line(color="gray",size=0.2), panel.background = element_rect(color = "black",fill = "transparent")) +geom_vline(xintercept = c(-1,1),color="gray",linetype=2,size=0.5)+geom_hline(yintercept = -log10(1),color='gray',linetype=2,size=0.5)
p <- p + theme(legend.title = element_blank(),legend.key = element_rect(fill='transparent'),legend.background = element_rect(fill = 'transparent'))
p <- p + xlim(-4,4) +ylim(0,40) ##X scale
p
ggsave("XY_XXmiRNAvalcano_plot.png",p,width = 4.5,height=5.5)
标记出你期望的基因名字
(1)首先需要做一个数据框. 假如为test
(2)导入 ggrepel 包
library(ggrepel)
(3)添加图层
p + geom_text_repel(data =test,aes(test$log2FoldChange,-log10(test$padj),label=test$Name))
或者用p +geom_label_repel(data = test,aes(test$log2FoldChange,-log10(test$padj),label=test$Name))
二、mRNA分析
选用hisat2+HTseq+DEseq2
1、hisat2:
run = "hisat2 -x ./Spinach_genome/spinach_genome_v1.fa -p 4 -1 "+i+" -2 "+j+" -S "+Out
2、HTSeq2
htseq-count -f bam -r name -s no -a 10 -t exon -i ID -m intersection-nonempty yourfile_name.bam ~/reference/hisat2_reference/Homo_sapiens.GRCh38.86.chr_patch_hapl_scaff.gtf > counts.txt
3、DEseq2
同上
关注下方公众号可获得更多精彩

miRAN 分析以及mRNA分析的更多相关文章
- 常用 Java 静态代码分析工具的分析与比较
常用 Java 静态代码分析工具的分析与比较 简介: 本文首先介绍了静态代码分析的基 本概念及主要技术,随后分别介绍了现有 4 种主流 Java 静态代码分析工具 (Checkstyle,FindBu ...
- Memcached源代码分析 - Memcached源代码分析之消息回应(3)
文章列表: <Memcached源代码分析 - Memcached源代码分析之基于Libevent的网络模型(1)> <Memcached源代码分析 - Memcached源代码分析 ...
- mysql 分析3使用分析sql 性能 show profiles ;
show variables like '%profiling%'; 查看状态 查看时间去哪了``` set profiling=1;// 打开 show profiles; 查看执行过的 ...
- [转载] 常用 Java 静态代码分析工具的分析与比较
转载自http://www.oschina.net/question/129540_23043 简介: 本文首先介绍了静态代码分析的基本概念及主要技术,随后分别介绍了现有 4 种主流 Java 静态代 ...
- x264源代码简单分析:宏块分析(Analysis)部分-帧间宏块(Inter)
===================================================== H.264源代码分析文章列表: [编码 - x264] x264源代码简单分析:概述 x26 ...
- x264源代码简单分析:宏块分析(Analysis)部分-帧内宏块(Intra)
===================================================== H.264源代码分析文章列表: [编码 - x264] x264源代码简单分析:概述 x26 ...
- loadrunner 结果分析-loadrunner结果分析
结果分析-loadrunner结果分析 by:授客 QQ:1033553122 百度网盘分享链接: 烦请 复制一下网址到浏览器中打开,输入密码提取 链接: http://pan.baidu.com/s ...
- ⑥NuPlayer播放源码分析之DecoderBase分析
NuPlayer播放源码分析之DecoderBase分析 [时间:2017-02] [状态:Open] [关键词:android,nuplayer,开源播放器,播放框架,DecoderBase,Med ...
- 【转载】常用 Java 静态代码分析工具的分析与比较
摘自:http://www.oschina.net/question/129540_23043常用 Java 静态代码分析工具的分析与比较 简介: 本文首先介绍了静态代码分析的基本概念及主要技术,随后 ...
随机推荐
- Mybatis 动态批量修改
封面:学校夜景 xdm,祝大家节日快乐!! 今天听<路过人间>演唱会Live限定版,爱上了一句歌词. 说来惭愧,人对爱只学会,视死如归. 1.业务需求 如下: 前台传给我一个 docume ...
- 计算机网络之网络层移动IP
文章转自:https://blog.csdn.net/weixin_43914604/article/details/105319753 学习课程:<2019王道考研计算机网络> 学习目的 ...
- 在Ubuntu下安装Solr
使用wget命令去官网下载solr的压缩包. 1 wget https://mirrors.bfsu.edu.cn/apache/lucene/solr/8.6.3/solr-8.6.3.tgz 使用 ...
- 【java+selenium3】线程休眠方法 (六)
一.线程休眠的方法 Thread -- sleep 调用方式: Thread.sleep(long millis) 建议:不推荐使用此方式来等待,因为元素的实际渲染时间未知,长时间的等待则浪费的时 ...
- 设计模式二--模板方法Template method
模式分类: 书籍推荐:重构-改善既有代码的设计 重构获得模式 设计模式:现代软件设计的特征是"需求的频繁变化".设计模式的要点是 "寻找变化点,然后在变化点处应用设计模式 ...
- Jackson & fastJson的使用
Jackson import lombok.Data; @Data public class Student { private Long id; private String name; priva ...
- 环境(6)Linux文件系统二
一:计算机间的数据传输 windows---linux : lrzsz :需要手动安装 yum install lrzsz -y ; rz 将文件从window上传到linux : ...
- GitHub 12个实用技巧-从projiect项目管理、代码链接到博客wiki全过程
1 在GitHub.com上编辑代码 2 粘贴图片 3 美化代码 4 在PRs中巧妙关闭issues 5 链接到评论 6 链接到代码 7 灵活使用GitHub地址栏 8 创建复选框列表 9 在GitH ...
- python爬取ip地址
ip查询,异步get请求 分析接口,请求接口响应json 发现可以data中获取 result.json()['data'][0]['location'] # _*_ coding : utf-8 _ ...
- NodeJS连接MongoDB和mongoose
1.MongoDB是一个基于分布式文件存储的数据库.由C++语言编写.旨在为WEB应用提供可扩展的高性能数据存储解决方案.是世界上目前用的最广泛的nosql数据库 2.noSql 翻译过来 not o ...
